L’ibridazione del carbonio
L’ibridazione consiste in un mescolamento fra orbitali atomici di diverso tipo, con formazione di orbitali ibridi che possiedono caratteristiche intermedie tra quelli di partenza.
Attraverso la teoria VSEPR, si possono individuare tre diversi tipi di legame che il carbonio può instaurare.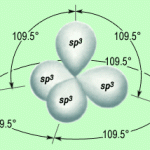
Tale teoria però non è sufficiente a spiegare in che modo l’atomo di carbonio utilizza i suoi elettroni per formare i tre tipi di legame che caratterizzano i suoi composti: il legame semplice, doppio e triplo.
Gli orbitali del carbonio sono degli orbitali ibridi aventi caratteristiche intermedie tra s e p.
Sulla base della teoria VSEPR è possibile prevedere:
1) quando un atomo di carbonio forma quattro legami singoli, intorno al nucleo sono presenti quattro nuvole elettroniche e tramite la teoria VSEPR è possibile prevedere che la molecola avrà una geometria tetraedrica: è questo il caso del metano CH4, il più semplice composto organico;
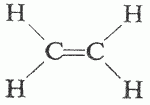
2) quando un atomo di carbonio forma un doppio legame e due legami singoli, intorno ad ogni atomo si dispongono tre nuvole elettroniche e tramite la teoria VSEPR è possibile prevedere che la molecola avrà una geometria planare trigonale: è questo il caso dell’etilene (etene) C2H4;
3) quando il carbonio forma un triplo legame e uno singolo, intorno ad ogni atomo si dispongono due nuvole elettroniche e tramite la teoria VSEPR è possibile prevedere che la molecola avrà una geometria lineare: è questo il caso dell’acetilene (etino) C2H2.