L’ibridazione sp e il triplo legame
La versatilità del carbonio si manifesta in una terza ibridazione dei suoi orbitali.
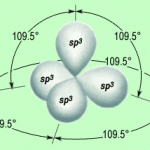
Se nell’ibridazione viene coinvolto un orbitale s e uno dei tre orbitali p si hanno due orbitali ibridi detti sp.
I tre orbitali ibridi così ottenuti sono detti orbitali ibridi del tipo sp.
I due orbitali ibridi così ottenuti presenteranno per metà le caratteristiche energetiche dell’orbitale 2s e per metà quelle dell’orbitale 2p, quindi la loro energia sarà inferiore a quella degli orbitali ibridi sp2 e sp3. Inoltre, nello strato di valenza, restano ancora intatti due orbitali non coinvolti nell’ibridazione.
I due orbitali ibridi sp si sistemano in direzioni opposte, raggiungendo la massima distanza, e, formando tra loro un angolo di 180°, assumono una struttura lineare. Quindi, i due orbitali si dispongono sulla stessa retta ma in direzione opposta.
I due orbitali p non coinvolti nell’ibridazione mantengono,invece, la loro forma a due lobi e restano perpendicolari tra loro e anche alla retta che passa per i due nuclei dei due atomi di carbonio.
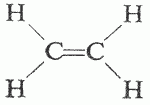
I due atomi di carbonio in tal modo ibridati possono legarsi tra loro mediante un legame σ e due legami π perpendicolari tra loro, mentre i due orbitali sp non coinvolti nell’ibridazione si legano con gli orbitali s di due atomi di idrogeno, formando la molecola di acetilene C2H2, caratterizzata dalla presenza di un doppio legame.
E’ stato possibile misurare la distanza C—C, che risulta considerevolmente ridotta, raggiungendo i valori di 1,21 Å, mentre risulta aumentata l’energia totale del triplo legame C☰C che raggiunge una forza complessiva di 198 Kcal/mol.
Con questo tipo di ibridazione si possono avere molecole che possiedono più di due atomi di carbonio disposti in strutture lineari o ramificate, mentre è meno probabile ottenere strutture cicliche, a causa della linearità di questo legame.